USC 연구자들이 개발한 새로운 인공지능 모델이 다양한 단백질이 DNA에 결합하는 방식을 정확하게 예측할 수 있게 됨. 이 기술적 발전은 새로운 약물 및 기타 의료 치료법 개발에 필요한 시간을 줄일 것으로 기대됨.
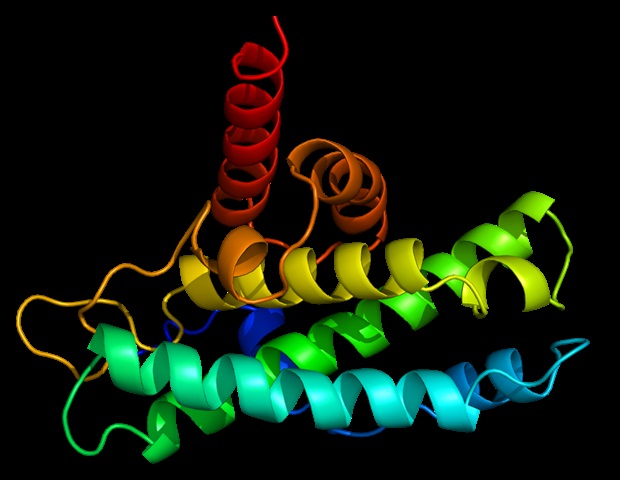
이 도구는 Deep Predictor of Binding Specificity(DeepPBS)라고 불리며, 단백질-DNA 복합체 구조에서 단백질-DNA 결합 특이성을 예측하기 위해 설계된 기하학적 딥러닝 모델임. DeepPBS는 과학자와 연구자들이 단백질-DNA 복합체의 데이터 구조를 온라인 계산 도구에 입력할 수 있게 함.
단백질-DNA 복합체의 구조는 일반적으로 단일 DNA 서열에 결합된 단백질을 포함함. 유전자 조절을 이해하기 위해서는 단백질이 어떤 DNA 서열이나 유전체의 영역에 결합하는 특이성에 접근하는 것이 중요함. DeepPBS는 단백질-DNA 결합 특이성을 밝히기 위해 고속 시퀀싱이나 구조 생물학 실험의 필요성을 대체하는 AI 도구임.
Remo Rohs 교수는 USC Dornsife College of Letters, Arts and Sciences의 정량적 및 계산 생물학과의 창립 의장임.
DeepPBS는 기하학적 딥러닝 모델을 사용하여 데이터의 기하학적 구조를 분석하는 기계 학습 접근 방식임. 이 AI 도구는 단백질-DNA의 화학적 특성과 기하학적 맥락을 포착하여 결합 특이성을 예측하도록 설계됨.
이 데이터를 사용하여 DeepPBS는 단백질 구조와 단백질 및 DNA 표현 간의 관계를 설명하는 공간 그래프를 생성함. DeepPBS는 또한 기존 방법들이 단일 단백질 계열에 제한되는 것과 달리 다양한 단백질 계열에 걸쳐 결합 특이성을 예측할 수 있음.
Rohs는 "연구자들이 모든 단백질에 대해 보편적으로 작동하는 방법을 사용할 수 있는 것이 중요하다. 이는 또한 새로운 단백질을 설계할 수 있게 해준다"고 말함.
단백질 구조 예측 분야는 DeepMind의 AlphaFold가 등장한 이후 빠르게 발전함. 이 도구들은 과학자와 연구자들이 분석할 수 있는 구조 데이터의 양을 증가시킴. DeepPBS는 실험 구조가 없는 단백질의 특이성을 예측하기 위해 구조 예측 방법과 함께 작동함.
Rohs는 DeepPBS의 응용 가능성이 많다고 언급함. 이 새로운 연구 방법은 특정 돌연변이를 가진 암세포에 대한 새로운 약물 및 치료법 설계를 가속화할 수 있으며, 합성 생물학 및 RNA 연구의 새로운 발견으로 이어질 수 있음.
이 연구는 Rohs 외에도 USC의 Raktim Mitra, Jinsen Li, UCSF의 Jared Sagendorf, USC의 Yibei Jiang, USC의 Ari Cohen, USC의 Tsu-Pei Chiu, 그리고 워싱턴 대학교의 Cameron Glasscock이 공동 저자로 참여함.
이 연구는 주로 NIH 보조금 R35GM130376의 지원을 받음.